Диэлектрические анодные оксидные пленки на вентильных металлах
Кислородные соединения различных элементов, оксиды, чрезвычайно разнообразны по своим свойствам. Широкое применение имеют оксиды в виде сравнительно тонких пленок, которые наносятся на поверхность полупроводников или металлов. Оксидные пленки формируются в результате химических или электрохимических реакций в поверхностном слое металла, а также путем осаждения или напыления на поверхность материала. В последнем случае, как правило, не происходит химической реакции материала подложки с наносимой оксидной пленкой.
Анодными оксидами (АО) или анодными оксидными пленками (АОП) принято называть оксидные слои, которые образуются на поверхности металлов и полупроводников при их анодной поляризации в растворах электролитов, расплавах солей, плазме газового разряда в кислороде и в контакте с некоторыми твердыми электролитами, обладающими ионной проводимостью по кислороду. В электронной промышленности большое применение находят диэлектрические АОП. Таковыми являются анодные оксиды, образованные на алюминии, тантале, ниобии, кремнии. Эти оксиды в системах металл-оксид-металл (МОМ), металл-оксид-электролит (МОЭ), металл-оксид-полупроводник (МОП) проявляют асимметрию проводимости, т.е. обладают вентильными свойствами. Реально оксиды всех металлов в МОЭ-системах в той или иной степени проявляют вентильные свойства. Тем не менее, исторически «вентильными» называют металлы и полупроводники, на которых образуются АОП с хорошими диэлектрическими свойствами (электрическое сопротивление ≥1014 Ом×м, электрическая прочность ≥108 В×м-1, ширина запрещенной зоны >3эВ). Типичными представители группы вентильных материалов являются металлы Al, Ta, Nb, Zr, Si и полупроводники InSb, InAs, GaAs.
Огромные возможности открываются при оксидировании металлов в растворах электролитов, поскольку применение различных электролитов позволяет варьировать структуру и морфологию пленок и, как следствие, их свойства.
При анодном окислении металлов (анодировании) обычно в качестве электролитов используют водные растворы кислот и их солей. В электролитах, не растворяющих анодный оксид, образуются плотные АОП, называемые также оксидами барьерного типа. Барьерные пленки могут быть сформированы на Al, Nb, Ti, W, Zr, Hf при соответствующем выборе раствора и параметров электрохимического процесса. Классическим примером металла, образующего плотные оксидные пленки, является тантал, анодная пленка на котором практически нерастворима почти во всех электролитах; более 99% тока при анодном оксидировании тантала расходуется на образование АОП.Для других вентильных металлов выход по току реакции оксидирования меньше 100%, т.к. часть тока расходуется на компенсацию растворения оксида, а часть - на электронный ток, связанный с окислительными реакциями (в первую очередь с реакцией разложения воды до образования кислорода).
Общие принципы формирования диэлектрических АОП
Интерес к изучению механизма и кинетики роста АОП, их структуры и свойств обусловлен связью проблем теории АОП с фундаментальными проблемами как физики конденсированного состояния (например, формирование ближнего порядка в аморфных АОП, поляризационные процессы и т.д.), так и электрохимии (пассивностьметалловиеенарушения), а также все возрастающим практическим применением анодных пленок различной функциональности.

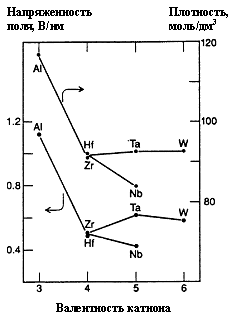
Общепринятым является тот факт, что при образовании и росте плотных АОП на вентильных металлах имеет место ионное движение в сильных полях с характерной экспоненциальной зависимостью ионного тока от напряженности поля. Причем, чем плотнее анионная упаковка в оксидной пленке, тем большее электрическое поле требуется для обеспечения ионного тока через нее (рис.1).
Подавляющее большинство развитых к настоящему моменту теорий ионного переноса при формировании диэлектрических АОП барьерного типа использует классический механизм ионного переноса. В соответствии с ним во время роста оксида под влиянием электрического поля происходит миграция, как катионов металла (Al3+, Ta5+ и др.), так и анионов O2-/OH- через естественную оксидную пленку, образованную на воздухе до анодирования. Причем для описания миграции ионов применяется в основном междоузельный или вакансионный механизм с использованием в общем случае четырех типов ионных дефектов: междоузельных катионов и анионов, катионных и анионных вакансий. В электрическом поле, действующем в растущей АОП, междоузельные катионы и анионные вакансии мигрируют к границе оксид/электролит, а междоузельные анионы и катионные вакансии – к границе оксид/металл, на границах и происходит образование новых слоев оксида.
Серия экспериментов по изучению процессов переноса в АОП вентильных металлов с помощью меченых атомов металла и кислорода, или инородных атомов, например, инертных газов, выполненная в 60-80х годах 20-го века, позволила определить числа переноса катионов и анионов, т.е. доли ионного тока, переносимого ионами металла и кислорода.Исследования с помощью «маркеров», которые внедрялись в начальный оксидный слой или в поверхностный слой оксидируемого металла, показали, что на многих металлах (Al, Ta, Nb, W и др.) при росте АОП, которые, как правило, являлись аморфными, в массопереносе участвуют как ионы металла, так и кислорода (табл.1, рис.2). А значит, при образовании плотных аморфных пленок таких металлов оксидные слои растут на обеих фазовых границах: на границе металл/оксид – в результате миграции кислорода, а на границе оксид/электролит – в результате миграции металла, причем «каналирования» ионов в оксиде не наблюдается.
Числа переноса катионов (tк) при анодном оксидировании металлов переходных групп
Металл |
Zr, Hf, Si |
Ta |
Nb |
W |
Al |
tк |
<0.10 |
0.24 |
0.27 |
0.37 |
0.56-0.60 |
Примечание. Значения приведены для гальваностатического режима оксидирования при плотности тока 1мА/см2 и температуре 25 oC.
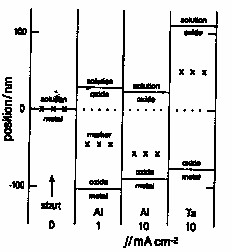
Рис.2. Схематическое изображение движения маркера и границ металл/оксид и оксид/электролит относительно фиксированной точки при гальваностатическом анодировании Al в 3% растворе цитрата аммония и Та в водном растворе 1М Na2SO4 при различных плотностях тока до 125 В при 25 oC. (Данные приведены после корректировки на потерю металла в раствор).
Необходимо отметить, что оксид алюминия является, вероятно, единственным анодным оксидом, который может быть сформирован в большом диапазоне толщин, как в аморфной, так и кристаллической формах.
В ходе изучения ионного переноса с помощью маркеров было также установлено, что при анодном оксидировании основная часть кислорода (~88%) поступает из воды и лишь незначительная часть – вместе с анионами электролита, внедряющимися в АОП.
Посредством многочисленных исследований состава пленок было доказано, что внутренние слои АОП барьерного типа на тантале, ниобии, алюминии состоят практически из чистых оксидов, а внешние части, сформированные на границе оксид/электролит за счет миграции ионов металла, содержат анионы электролита. Причем степень внедрения и толщина слоя, содержащего анионы, зависела от природы электролита и условий анодирования. Чем выше концентрация растворов кислот или солей, используемых при анодировании, тем больше анионов внедряется в оксид.
Таким образом, анализ данных о формировании АОП позволяет сделать вывод о том, что вклад в ионный перенос в растущей АОП и, соответственно, перенос заряда, дает как миграция ионов металла, так и кислорода. Соотношение этих процессов изменяется в зависимости от того, какой металл подвергается анодированию, и какова плотность тока процесса. Раствор же анодирования имеет меньшее влияние на процесс переноса, если только не приводит к формированию пористых пленок.
В соответствии с изложенным выше становится ясно, что современное состояние теории ионного переноса, несомненно, требует усовершенствования, прежде всего в области развития теории мультиионной миграции, поскольку для большинства металлов характерна как катионная, так и анионная подвижность, каждая из которых в свою очередь может быть многокомпонентной.
Важным следствием экспериментальных исследований ионного переноса является также то, что не может существовать особых ионных носителей (например, междоузельных ионов), которые могут перемещаться на большие расстояния путем нескольких последовательных перескоков, т.е. каждый ион может смещаться не более чем на одно элементарное, близкое к межатомному, расстояние. Причем миграция катионов и анионов взаимосвязана, т.е. смещение иона кислорода неизбежно требует соответствующего смещения иона металла. Поскольку все атомы в оксиде принимают участие в миграции, то утолщение АОП даже на один атомный слой требует движения всех атомов в оксидной пленке.
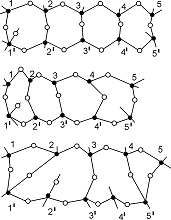
Рис.3. Схема распространения переключения связей в сетке аморфного оксида.
Образование таких связей позволяет рассматривать ионный перенос как распространение в матрице аморфного оксида некоторого возмущения без нарушения порядка атомов. Вполне понятно, что при таком механизме переноса новые слои оксида могут образовываться только на границах фаз.
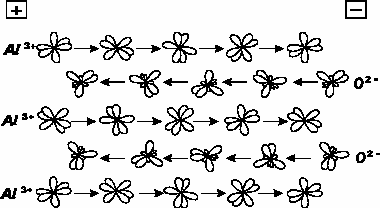
Рис.4. Направленное передвижение ионов внутри барьерного слоя при анодном оксидировании алюминия встречными струями по принципу «спортивного командного послематчевого рукопожатия» Al3+ sp3d2, O2- sp3- гибридизация.
Составляющие встречные потоки ионы алюминия и кислорода (рис. 4) мигрируют струями в электрическом поле с одновременным эстафетным характером взаимодействия с ионами противоположного потока. Электрическое поле, обуславливая направление движения ионов, одновременно обеспечивает скольжение их по гибридным валентным электронным облакам ионов противоположного знака соседних встречных потоков по принципу «командного послематчевого рукопожатия». Возникает лишь временное перекрывание электронных облаков. Напряженность внешнего электрического поля способствует разрыву намечающейся, но не устанавливающейся связи, т.е. в процессе формирования АОА его барьерный слой следует рассматривать динамически подвижной системой.
Для большинства металлов эффективность формирования АОП меньше 100%, часть тока расходуется на другие анодные процессы, одним из которых является растворение оксидной пленки. Так, при анодировании алюминия часто имеет место конкуренция нескольких анодных процессов, таких как образование пленки, ее растворение и растворение металла (питтинг). Это обеспечивает возможность формирования АОП на алюминии с широким спектром структурно-морфологических и электрофизических характеристик за счет изменения состава электролита и условий процесса анодирования. В соответствии с этим на алюминии (и целом ряде сплавов на его основе) путем электрохимического оксидирования можно получать как плотные, так и пористые АОП, в том числе уникальные пленки с регулярно-пористой морфоструктурой.
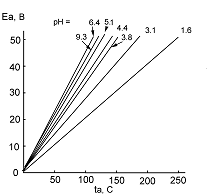
Рис.5. Изменение потенциала анода со временем при анодировании алюминия при постоянной плотности тока 1мА/см2 в 0.1М фосфатном растворе при разных рН.
АОП барьерного типа на алюминии формируются при постоянной напряженности поля порядка 108 –109 В/м, при этом пленки утолщаются со скоростью ~ 1.2-1.4 нм/В. При формировании плотных АОП на алюминии в гальваностатических условиях толщина пленки вполне определяется значением напряжения анодирования, поскольку Ua ≈ k•δох, где 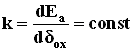 (Ea- напряженность электрического поля во вновь образующихся слоях АОП; dох – толщина пленки). В гальваностатическом режиме (ГСР) барьерообразующего анодирования алюминия анодный потенциал, а с ним и напряжение на электролитической ячейке растут со временем линейно (рис. 5).
(Ea- напряженность электрического поля во вновь образующихся слоях АОП; dох – толщина пленки). В гальваностатическом режиме (ГСР) барьерообразующего анодирования алюминия анодный потенциал, а с ним и напряжение на электролитической ячейке растут со временем линейно (рис. 5).
Для того, чтобы поддерживать постоянную напряженность поля, напряжение должно увеличиваться по мере утолщения пленки. Поле обеспечивает однородный рост пленки со сглаживанием шероховатостей исходной поверхности металла. Однородное утолщение пленки заканчивается диэлектрическим пробоем с видимым искрением. Напряжение пробоя (рисUпр зависит от природы растворителя, анионного состава электролита и его концентрации: чем более разбавлен раствор, тем выше Uпр. Практически верхним пределом напряжения оксидирования Al является 1000 В, Та – 500 В, ниобия – 250 В, а предельные толщины барьерных АОП: 1.4 мкм, 0.9 мкм и 0.6 мкм, соответственно.
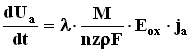 , (1)
, (1)
где λ - эффективность формирования оксидной пленки, которая определяется как отношение ионного тока к полному току, протекающему через систему; М – молекулярный вес оксида,ρ - его плотность, nz –валентность реакции образования АОП, Еох - дифференциальная напряженность поля в растущей части оксидного слоя. В таком случае при эффективности роста 100% (как при формирования АОП на Ta и Nb) изменение ![]() будет свидетельствовать либо об изменении молярного объема, либо дифференциальной напряженности поля в растущем оксиде , либо о появлении каких-либо побочных реакций, уменьшающих долю ионного тока. Исследование кинетических зависимостей анодирования тантала и ниобия в водных растворах H3PO4 показало, что скорость роста напряжения не меняется вплоть до концентрации кислоты, равной 50%, а при больших концентрациях растет. Было установлено, что причиной этого является увеличение молярного объема M/p и напряженности поля Еох и, по мнению авторов, связано с внедрением вещества электролита в оксидные пленки.
будет свидетельствовать либо об изменении молярного объема, либо дифференциальной напряженности поля в растущем оксиде , либо о появлении каких-либо побочных реакций, уменьшающих долю ионного тока. Исследование кинетических зависимостей анодирования тантала и ниобия в водных растворах H3PO4 показало, что скорость роста напряжения не меняется вплоть до концентрации кислоты, равной 50%, а при больших концентрациях растет. Было установлено, что причиной этого является увеличение молярного объема M/p и напряженности поля Еох и, по мнению авторов, связано с внедрением вещества электролита в оксидные пленки.
Таким образом, анализ кинетических зависимостей может дать определенную информацию об особенностях роста АОП. Однако подобная интерпретация Ua(t), полученных при анодировании в ГСР Al даже в барьерообразующих растворах может осложниться протеканием наряду с ионным током роста оксида, токов растворения и электронных токов. При этом эффективность роста барьерных АОП на алюминии становится заметно ниже 100%.
Задание: Исследовать кинетику роста плотных анодных оксидов алюминия в борнокислом электролите в гальваностатическом режиме в зависимости от плотности тока и/или состава металла.
Упражнение 1. Изучить процесс оксидирования в гальваностатическом режиме.
1.Для нескольких значений плотности тока (в интервале ja=1÷5 мА/см2) провести оксидирование образцов до напряжения формирования≤200В. При этом для каждой плотности тока записать и затем построить зависимость изменения напряжения (Ua) на электродах ячейки от времени (ta). Зависимость должна быть построена не менее чем по 10 экспериментальным точкам. Результаты занести в таблицу.
2. Из анализа зависимости определить скорость роста напряжения (dUa/dt) для каждой из использованных плотностей тока и оценить исходя из них c помощью формулы (1) напряженность поля роста оксида Eox.
![]() , (2)
, (2)
и коэффициент a, называемый также постоянной роста оксида, имеет величину порядка 1.4 нм/В, то это позволяет найти из (2) скорость роста толщины оксида (dd/dt) при использованных условиях анодирования.
4. На основании полученных данных построить зависимость скорости роста напряжения (dUa/dt) в функции плотности тока анодированияja. Исходя из (1), скорость роста напряжения должна линейно зависеть от плотности тока анодирования.
Упражнение 2. Изучить характер зависимости толщины оксида от напряжения оксидирования.
1.Проводить оксидирование образца при одном значении плотности тока до различных напряжений, так, чтобы во всем интервале анодирования получить 5-7 различных напряжений анодирования.
2. После каждого режима производить измерение электроемкости образца в той же самой ячейке и в том же электролите, в котором проводилось оксидирование. С этой целью использовать мост для измерения емкости, в котором имеется источник переменного напряжения порядка 100мВ.
![]() , (3)
, (3)
где S – площадь поверхности образца, а d пропорциональна напряжению формирования оксида, удобно построить зависимость обратной электроемкости от напряжения анодирования, которая должна носить линейный характер.
4. По полученным данным с помощью формулы (3) рассчитать толщину оксида для каждого напряжения и оценить константу оксидирования .
Контрольные вопросы